

2021年10月30日
令和3年度 量子医療推進講演会 量子とゲノムが拓く未来のがん医療
国立研究開発法人 国立がん研究センター
理事長
がんゲノム医療について解説していただいた。難治・希少がんも視野に入れて、がんゲノム医療というのがどう貢献ができるのか、薬が届かないがん種に関して何が可能なのかを解説された。
がんの発生理由について、最近ではがんは複数の遺伝子異常、ゲノム異常が蓄積して発生すると考えられている。ゲノム異常は大別して融合遺伝子の群と遺伝子変異の群、その他の三つに分けられる。通常では見られない二つの遺伝子がくっついて機能を獲得する融合遺伝子が主にがん化の働きをしているグループが一つ。がん遺伝子、がん抑制遺伝子といったよく知られている遺伝子に傷が入って、それが原因となってがん化が急速に進んだと思えるもの。さらにそのいずれでもないもの。ただし、三つ目のグループではいろいろな遺伝子に様々な傷が非常に多いことが分かっている。
2000年代より前の時代の薬には細胞を殺す殺細胞治療薬が多い。細胞増殖をブロックする機能を持つ薬、いわゆる化学療法剤が開発された。また、増殖に関わるシグナルに重要な働きをしているたんぱく質の機能を抑えるような薬として分子標的薬が開発されている。2000年以降はこういう薬が主流となり、2000年以前の分子生物学的な研究成果であるがんの増殖に関わる重要な遺伝子の産物、たんぱく質を抑える薬が開発されてきた。
2010年以降になると免疫チェックポイント阻害剤が主流となっている。かつて1980年ごろは大腸がんの平均寿命は大体5か月であったが、最近では進行した大腸がんでも平均寿命が三十数か月となっており、この30~40年間で6倍以上に生存率が改善している。
キーとなっているゲノム異常を見つけて、それに対する適切な治療薬――分子標的薬を開発する、ゲノム異常に対応することにより効果的な治療ができるのではないかというのががんのゲノム医療という考え方である。がんセンターでは、2013年頃から二つのプロジェクト、SCRUM-JapanプロジェクトとTOP-GEARプロジェクトに取り組んでいる。SCRUM-Japanプロジェクトは、企業等と連携をしながら薬の開発をしていく、その中でゲノム情報を集めながら薬の開発をするという仕組み。
TOP-GEARプロジェクトは、実際にゲノム情報に基づいたがん医療の検証、先の肺がんの例のように劇的に効くかどうか、実際診療現場でそれが実施できるのか、ゲノム医療が実装できるのかということを検証するものである。医療現場で遺伝子検査が実装可能かどうかについては、病院の中の検査室に開発会社、検査会社を入れ、検査レベルの環境の中で遺伝子シークエンス、ゲノムシークエンスを行った。
ここでは、調べる遺伝子を114個に絞り込み、この114個搭載したパネルが承認された。実際にがんセンターで遺伝子異常に見合った薬が投与できた患者は13%。およそ6割に遺伝子変異が見つかるが、最終的に薬の投与ができたのが13%であるのが現状である。ゲノム医療では、ゲノム検査、遺伝子検査をすることが一つのプロセス、方法論であり、データを蓄積することによって薬の開発につなげていく、臨床開発の体制をつくり上げる、これが非常に重要である。
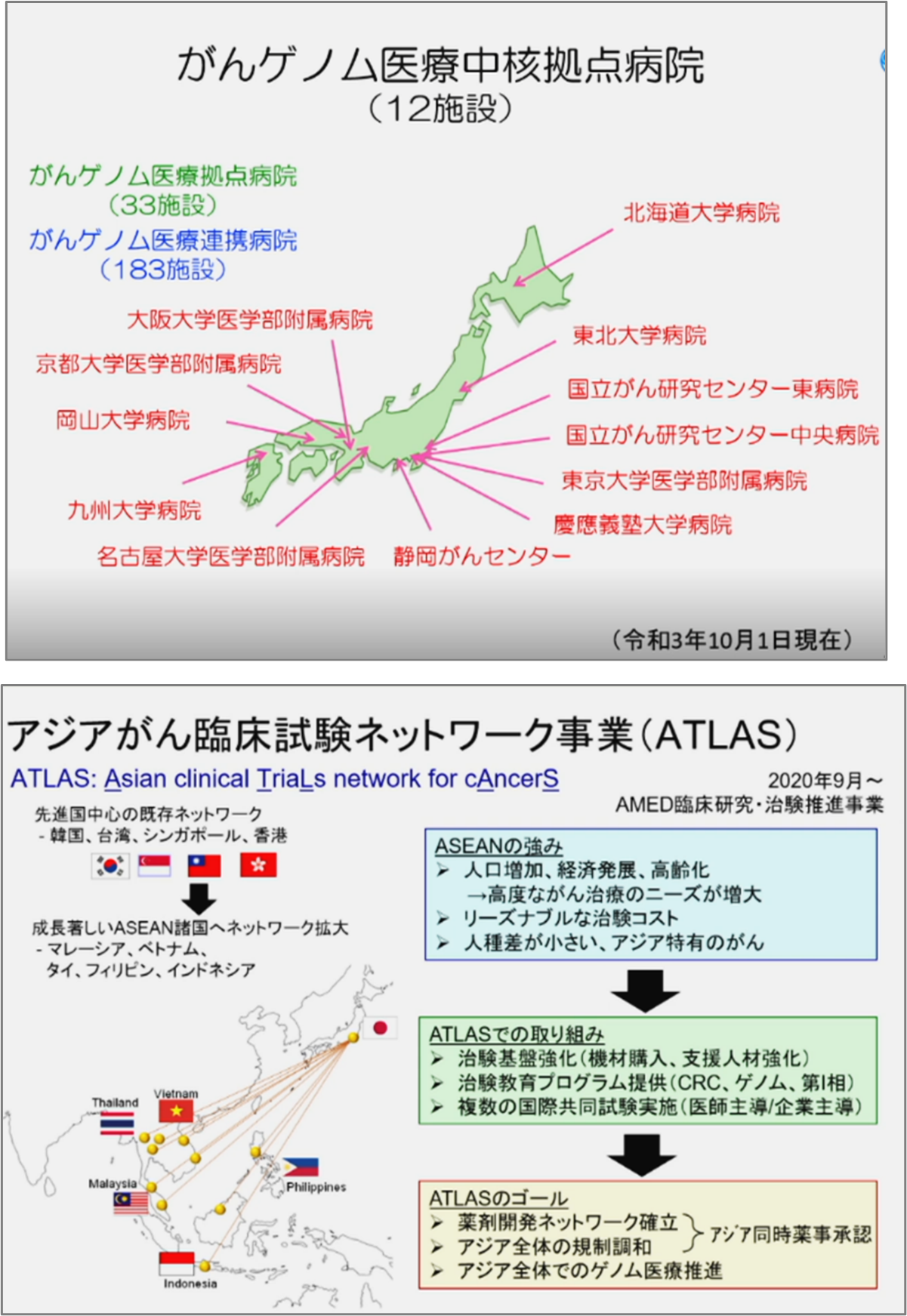
第3期のがん対策推進基本計画は平成30年の3月公表、平成29年度から実施され、がん医療の充実の中の最初にがんゲノム医療が掲げられた。ゲノム医療の中核拠点、あるいはゲノム医療の拠点、さらには連携病院が、今年の10月1日現在で228施設である。中核拠点が12、さらにそれと同等の機能を持ち開発研究もできるというところが33施設、さらには、中核拠点、拠点と連携しながらゲノム医療を医療現場で実装する、あるいは患者を紹介し、ゲノム検査を行い遺伝子のレジストリを作成する連携病院が183施設である。この体制の中でのデータの利活用は、単に薬の開発だけではなくて、新しい医療AIの開発、診断機器・診断技術の開発、医療技術の開発にもつながっていくと期待される。
C-CATは、日本語で「がんゲノム情報管理センター(Center for Cancer Genomics and Advanced The Therapeutics)」、医療現場で専門家が議論する「エキスパートパネル」が中心となる。この体制で、医療データ、ビッグデータが保険診療下でオールジャパンから集められ、広く使われるということが非常に重要となる。令和3年10月4日からデータとして利活用できるという仕組みが開始された。
パネルから全ゲノムへの移行についても解説された。現在、10%内外の患者の治療薬到達率を、25%、30%、40%に上げることを目指し、全ゲノムの解析が日本中で進められようとしている。全ゲノムに関しては、AMEDという国の研究事業の中で10カ所の拠点が選ばれ、それぞれが連携を取りながら、全ゲノムが実際に医療実装可能かということを検証する研究がスタートしている。C-CAT、いわゆる保険診療のパネル検査とは別に、全ゲノムの研究が始まったところである。
MASTERKEYという希少がんの患者を登録する仕組みを、日本だけではなくて、似たようながんが起きるアジア諸国に広げられると、そのデータベースは一気に拡張されることが期待される。今年からAMEDの支援を受けて行っているATLASという事業で、現在、東南アジアの5か国と連携をしながら、15拠点でレジストリを作り、そのレジストリで臨床開発研究をアジア主導で進める活動が始まっている。アジア地域固有のがんに対する治療薬戦略、それからアジアの中でのデータベース構築を日本が諸外国と連携しながら行うことによって、これまでの治療薬開発のスキームを大きく変えていくきっかけになると考えられる。

国立研究開発法人 国立がん研究センター
理事長
1982年 東京大学医学部卒業
1990年 東京大学医学部附属病院 助手
1991年 米国マサチューセッツ工科大学 がん研究センター 研究員
1995年 国立がんセンター研究所 発がん研究部発がん促進物質研究室長
1997年 国立がんセンター研究所 生化学部長
2007年 国立がんセンター研究所 副所長
2010年 国立がん研究センター研究所 副所長
2011年 国立がん研究センター 研究所長
2012年 国立がん研究センター 理事 2016年 国立がん研究センター 理事長(現在に至る)
主な受賞:日本癌学会 長與又郎賞(令和3年)